Читаем онлайн «Химия. Полный справочник для подготовки к ЕГЭ»
- 123 . . . последняя (6) »
Р. А. Лидин Химия: Полный справочник для подготовки к ЕГЭ
Предисловие
Справочник включает весь теоретический материал школьного курса химии, необходимый для сдачи ЕГЭ, – итоговой аттестации учащихся. Этот материал распределен по 14 разделам, содержание которых соответствует темам, проверяемым на ЕГЭ, – четырем содержательным блокам: «Химический элемент», «Вещество», «Химическая реакция», «Познание и применение веществ и химических реакций». К каждому разделу даны тренировочные задания из частей А и В – с выбором ответа и кратким ответом. Раздел 15 полностью посвящен решению расчетных задач, включенных в экзаменационную часть С. Тестовые задания составлены таким образом, что, отвечая на них, учащийся сможет более рационально повторить основные положения школьного курса химии. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы. Для удобства работы с данным справочником приведена таблица, где указано соответствие между тематикой экзамена и разделами книги. Пособие адресовано старшим школьникам, абитуриентам и учителям.






1. Распространенные элементы. строение атомов. Электронные оболочки. Орбитали
Химический элемент– определенный вид атомов, обозначаемый названием и символом и характеризуемый порядковым номером и относительной атомной массой. В табл. 1 перечислены распространенные химические элементы, приведены символы, которыми они обозначаются (в скобках – произношение), порядковые номера, относительные атомные массы, характерные степени окисления. Нулевая степень окисления элемента в его простом веществе (веществах) в таблице не указана.

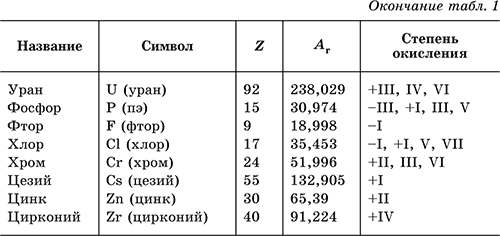
Все атомы одного элемента имеют одно и то же число протонов в ядре и число электронов в оболочке. Так, в атоме элемента водород Н находится 1р+ в ядре и на периферии 1е-; в атоме элемента кислород О находится 8р+ в ядре и 8е- в оболочке; атом элемента алюминий Аl содержит 13р+ в ядре и 13е- в оболочке. Атомы одного элемента могут различаться числом нейтронов в ядре, такие атомы называются изотопами. Так, у элемента водород Н три изотопа: водород-1 (специальное название и символ протий 1H) с 1 р+ в ядре и 1е- в оболочке; водород-2 (дейтерий 2Н, или D) с 1р+ и 1п0 в ядре и 1е- в оболочке; водород-3 (тритий 3Н, или Т) с 1р+ и 2п0 в ядре и 1е- в оболочке. В символах 1Н, 2Н и 3Н верхний индекс указывает массовое число– сумму чисел протонов и нейтронов в ядре. Другие примеры:

Электронную формулу атома любого химического элемента в соответствии с его расположением в Периодической системе элементов Д. И. Менделеева можно определить по табл. 2.


Электронная оболочка любого атома делится на энергетические уровни (1, 2, 3-й и т. д.), уровни делятся на подуровни (обозначаются буквами s, р, d, f). Подуровни состоят из атомных орбиталей – областей пространства, где вероятно пребывание электронов. Орбитали обозначаются как 1s (орбиталь 1-го уровня s-подуровня), 2s, 2р, 3s, 3р, 3d, 4s… Число орбиталей в подуровнях:

Заполнение атомных орбиталей электронами происходит в соответствии с тремя условиями: 1) принцип минимума энергии
Последовательность нарастания энергии подуровней:Электроны заполняют орбитали, начиная с подуровня с меньшей энергией.
- 123 . . . последняя (6) »
